Periodická soustava prvků
13. 7. 2021 2021-08-04 13:57Periodická soustava prvků
Periodická soustava prvků
PERIODICKÁ SOUSTAVA PRVKŮ
Autor: Dmitrij Ivanovič Mendělejev
Ruský chemik Dmitrij Ivanovič Mendělejev (8.2.1834 – 2.2.1907) formuloval periodickou tabulku prvků, která je jedním z nejužitečnějších a nejdůležitějších zevšeobecnění chemie i
celé vědy.
Narodil se v Toboľsku na Sibiři (nyní Tjumeňská oblast) jako čtrnácté a poslední dítě Ivana Pavloviče Mendělejeva, učitele ruské literatury, a Marie Dmitrijevny Kornilevové, která pocházela ze sibiřské obchodní rodiny.
Roku 1850 se přihlásil na Fakultu fyziky a matematiky při Hlavním pedagogickém institutu v Saint Petersburgu, kde v roce 1855 promoval s oslnivým výsledkem.

Po ukončení studií se v letech 1855-86 zabýval vztahy mezi krystalovými soustavami a
chemickým složením látek. Kromě teoretického výzkumu bylo jedním z jeho hlavních zájmů,
použití vědy v průmyslu a ekonomii.
Roku 1859-60 pracoval na Heidelberské univerzitě, kde spolupracoval s Robertem W.
Bunsenem. Roku 1860 zavedl Mendělejev pojem kritické teploty a v témže roce také navštívil
první Mezinárodní chemický kongres v Karlsruhe, kde díky názorům na atomovou hmotnost
přišel na základní myšlenku periodické tabulky.
Roku 1864-66 zastával místo profesora chemie na Technologickém institutu v Saint
Petersburgu a roku 1867-90 působil taktéž jako profesor na Saint Petersburské univerzitě.
Mendělejev se snažil nalézt nějaké vhodné texty pro své studenty, ale na žádné vyhovující
studijní materiály nenarazil.
Proto napsal své vlastní – Základy chemie, které vyšly v mnoha vydáních v různých jazycích.
Myšlenky potřebné k napsání knihy vedly Mendělejeva k formulaci periodického zákona v
březnu 1869.
Periodický zákon řadil tenkrát známé prvky podle jejich atomové hmotnosti a také
předpovídal existenci dalších chemických prvků.
Mendělejev mimo jiné pracoval na zkapalnění plynů, na rozpínavosti kapalin a na ruských
měrových jednotkách.
Taktéž se zabýval teorií roztoků, teorií anorganického původu ropy a chemií uhlí.
Roku 1868 pomohl založit Ruskou chemickou společnost.
Roku 1906, pár měsíců před svou smrtí, bohužel nezískal Nobelovu cenu za chemii o pouhý
jeden jediný hlas.
PERIODICKÝ ZÁKON
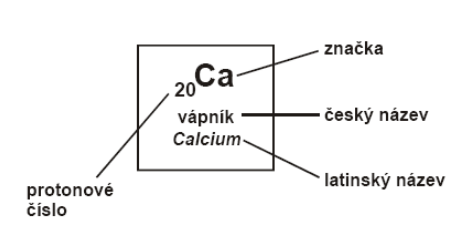
Vlastnosti prvků jsou periodicky závislé na protonovém čísle jejich atomů.
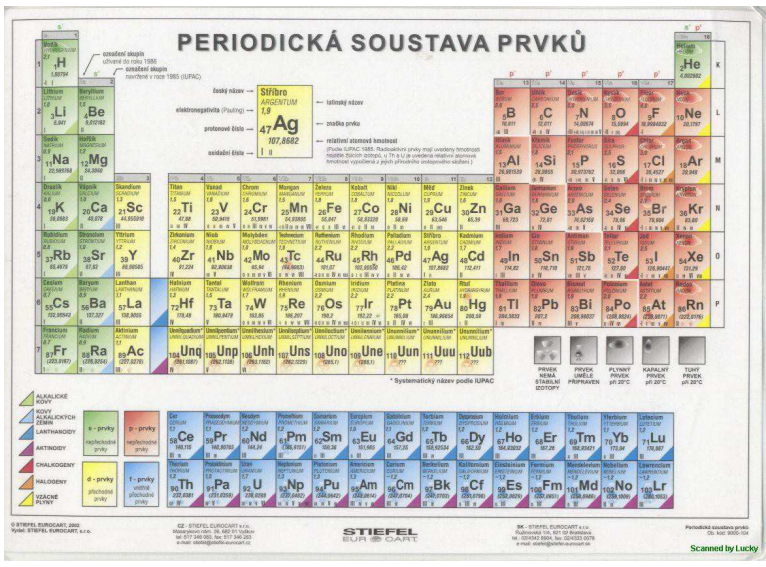
Prvky jsou uspořádány v tabulce
• podle stoupajícího počtu protonů
• do sedmi vodorovných řad, tzv. PERIOD
- označují se arabskou číslicí
- číslo periody udává počet vrstev v elektronovém obalu
- 14 prvků 6. periody je vyčleněno z periodické tabulky – lanthanoidy
- 14 prvků 7. periody je vyčleněno z periodické tabulky – aktinoidy
• do 18 sloupců, které tvoří 16 SKUPIN
- označují se římskými číslicemi I. A až VIII. A a I.B až VIII.B
- prvky zařazené do skupin A se nazývají nepřechodné, skupin B přechodné,
ostatní jsou vnitřně přechodné
ROZDĚLENÍ PRVKŮ:
Nepřechodné prvky – prvky ve skupinách A
Přechodné prvky – prvky ve skupinách B
Vnitřně přechodné prvky – lanthanoidy a aktinoidy