Kyseliny kyslíkaté
15. 7. 2021 2021-08-04 14:03Kyseliny kyslíkaté
Kyseliny kyslíkaté


Pokud je v molekulách kyseliny vázáno více odštěpitelných atomů vodíku, vyjadřujeme jejich
počet číslovkovými předponami: tři=tri-, čtyři=tetra- a latinským názvem vodíku – hydrogen.
Např.: kyselina trihydrogenfosforečná H3IPVO4-II
Zástupci:
Kyselina sírová H2SO4
Vlastnosti:
• Bezbarvá olejovitá kapalina
• Silná žíravina
• Koncentrovaná je 96%
• Její hustota je téměř 2x větší než hustota vody
• Má dehydratační účinky – přírodním látkám odnímá vodu, látky černají a uhelnatí
Reakce:
• Štěpení na ionty (při dostatečném zředění ve vodném roztoku)
• Reakce s kovy:
• Reakce s oxidy kovů:

Výroba: 3 základní reakce:
• Nejdříve se vyrobí oxid siřičitý SO2, nejčastěji spalováním síry
• V reaktoru s katalyzátorem (např. s oxidem vanadičním) reaguje oxid siřičitý se
vzdušným kyslíkem na oxid sírový:
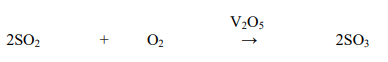
• Oxid sírový je pohlcován v roztoku kyseliny sírové. Kyselina sírová vzniká reakcí
oxidu sírového s vodou:
Použití:
• Výroba průmyslových hnojiv – superfosfátů
• Výroba výbušnin, barviv, léčiv, plastů
• Nezbytná chemikálie v laboratořích
• Používá se i v textilním, papírenském a potravinářském průmyslu
• Její 32% roztok se používá jako náplň olověných akumulátorů např. pro osobní
automobily
• Nachází se i v žaludku některých živočichů, např. žraloka, kde usnadňuje jeho trávení

Kyselina dusičná HNO3
Vlastnosti:
• Nestálá bezbarvá kapalina
• Nebezpečná žíravina, jejím rozkladem vzniká jedovatý oxid dusičitý NO2
• Koncentrovaná je 65-68%
• Účinkem světla se rozkládá a vznikající oxid dusičitý NO2 ji zbarvuje žlutě až
hnědočerveně (uchovává se v tmavých lahvích)
• Koncentrovaná reaguje s většinou kovů, výjimkou je zlato a platina. Tyto kovy
rozpustí jen lučavka královská (=směs jednoho dílu koncentrované HNO3 a tří dílů
koncentrované HCl)
Reakce:
• Štěpení na ionty:
• Reakce s kovy:
Výroba: 3 základní reakce:
• Výchozí látkou je amoniak NH3, který při zvýšené teplotě, tlaku a za přítomnosti
katalyzátoru (Pt) reaguje s kyslíkem a vzniká oxid dusnatý NO:
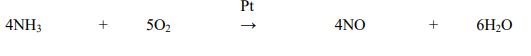
• Oxid dusnatý samovolné reaguje s kyslíkem a vzniká oxid dusičitý NO2:
• Závěrem oxid dusičitý reaguje s vodou, vzniká kyselina dusičná a oxid dusnatý, který
se znovu vrací to výroby:
Použití:
• Výroba průmyslových hnojiv – dusičnanů (ledků)
• Výroba léčiv, plastů, barviv a výbušnin např. dynamitu
• Součást kapalných raketových paliv
• Zábavná pyrotechnika
Kyselina uhličitá H2CO3:
• Jedna z nejslabších kyselin
• Existuje pouze ve vodném roztoku
• Vzniká při rozpouštění plynného oxidu uhličitého CO2 ve vodě
• Snadno se teplem rozkládá na oxid uhličitý CO2 a vodu
• Její roztok obsahují nápoje – sodovka, perlivá voda, sycené limonády i některé
alkoholické nápoje
Kyselina siřičitá H2SO3
• Slabá kyselina
• Existuje pouze ve vodném roztoku
• Vzniká při reakci oxidu siřičitého SO2 s vodou
• Vzniká i ve vzduchu – při spalování uniká oxid siřičitý, reaguje s kapičkami vody a
vzniká tato kyselina, její zředěný roztok potom padá k zemi ve formě dešťů, které
proto označujeme „kyselé deště“
Kyselina chlorná HClO:
• Slabá kyselina, snadno se rozkládá
• Vzniká při zavádění chloru do vody
• Velmi účinně ničí bakterie
• Využívá se jako součást desinfekčních prostředků (Pozor – časem se rozkládá a ztrácí
své bělící a desinfekční účinky)
• Výroba chemických látek, které tvoří součást pracích, čistících a bělících
prostředků běžně užívaných v domácnostech




