Elektrolýza
15. 7. 2021 2021-08-04 14:05Elektrolýza
Elektrolýza
ELEKTROLÝZA
ELEKTROLÝZA je děj probíhající na elektrodách při průchodu stejnosměrného
elektrického proudu roztokem nebo taveninou.
Roztok nebo tavenina musí obsahovat volně pohyblivé ionty (kationty a anionty).
Např. elektrolýza roztoku jodidu zinečnatého ZnI2:
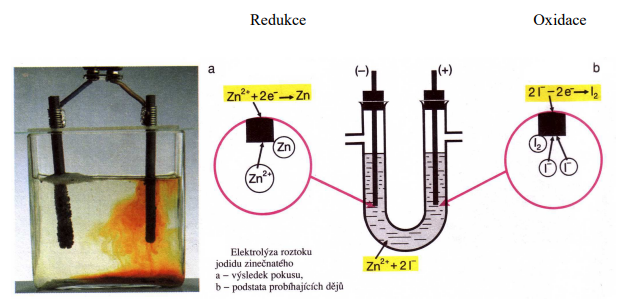
Při elektrolýze se kladně nabité kationty pohybují směrem k záporné elektrodě – katodě.
Záporně nabité anionty se pohybují směrem ke kladné elektrodě – anodě.
• Na záporné elektrodě zinečnaté kationty přijímají elektrony (redukují se) a vzniká
kovový zinek.
• Na kladné elektrodě jodidové anionty odevzdávají elektrony (oxidují se), vznikají
nejdříve atomy a potom molekuly jodu
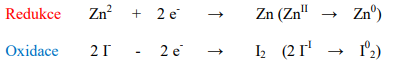
Při elektrolýze probíhá redoxní reakce. Na katodě probíhá redukce a na anodě probíhá
oxidace.
PRŮMYSLOVÉ VYUŽITÍ ELEKTROLÝZY
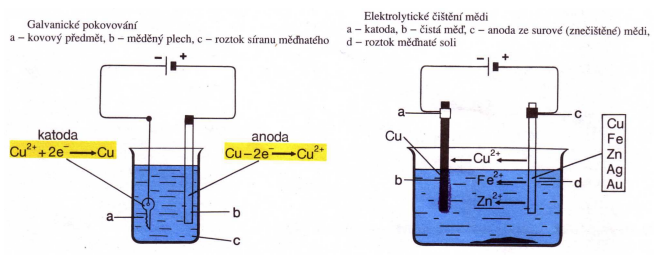
1. Galvanické pokovování
2. Elektrolytické čištění kovů, např. mědi
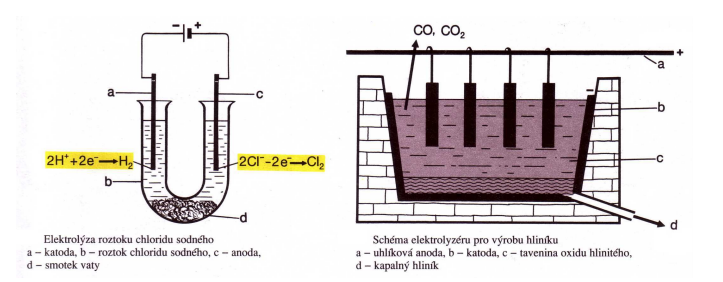
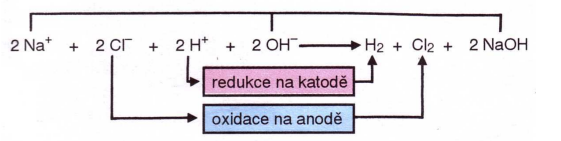
3. Elektrolýza vodného roztoku chloridu sodného
Na záporné elektrodě (katodě) se vylučuje plynný vodík H2 a v roztoku je hydroxid
sodný.
Na kladné elektrodě (anodě) se vyvíjí plynný chlor Cl2
Hydroxid sodný zůstává po elektrolýze v roztoku a získává se z něj odpařováním
vody.
Průmyslovou elektrolýzou vodného roztoku chloridu sodného NaCl se tedy
vyrábí vodík H2, chlor Cl2 a hydroxid sodný NaOH.
4. Výroba některých kovů
Kovy, které reagují s vodou, nelze vyrábět elektrolýzou jejich vodných roztoků.
Používají se tedy jejich roztavené sloučeniny.
Průmyslově se elektrolýzou tavenin vyrábějí např. sodík Na, hořčík Mg, hliník
Al.
Nejvýznamnějších z kovů vyráběných elektrolýzou je hliník.
Rudou pro výrobu hliníku je bauxit, který obsahuje 40-60% vázaného oxidu hlinitého
Al2O3.
Při elektrolýze taveniny se na katodě vylučuje kapalný hliník a na anodě vzniká
kyslík, který reaguje s uhlíkovými elektrodami za vzniku oxidů uhlíku (uhelnatého CO
a uhličitého CO2).
Výroba hliníku je velice náročná na spotřebu elektrické energie. Proto je hospodárný
sběr hliníkového odpadu.
Při jeho zpracování na čistý hliník je spotřeba elektrické energie o více než 90%
menší.