Molekuly a sloučeniny
13. 7. 2021 2021-08-04 13:56Molekuly a sloučeniny
Molekuly a sloučeniny
MOLEKULY A SLOUČENINY
Volné atomy prvků se v přírodě vykytují pouze ojediněle, např. prvky VIII. A skupiny –
netečné (inertní) plyny, He, Ne, Ar.
Atomy ostatních prvků se vzájemně spojují do složitějších celků – molekul.
MOLEKULA = částice tvořená ze dvou nebo více sloučených atomů.
Molekuly se vyznačují přesně definovaným uspořádámín atomů
Z molekul je složená naprostá většina chemických látek:
1. Molekuly mohou být vytvořeny z atomů stejného prvku = molekuly prvků
H2 = Jedna dvouatomová molekula vodíku
O2 = Jedna dvouatomová molekula kyslíku
2P4 = Dvě čtyřatomové molekuly fosforu (z osmi atomů fosforu)
S8 = Jedna osmiatomová molekula síry
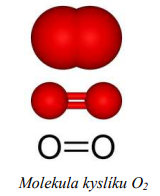
2. Častěji však molekuly vznikají slučováním atomů různých prvků = molekuly
sloučenin:
H2O = Jedna molekula vody, složená ze 2 atomů vodíku a 1 atomu kyslíku
3H2O = Tři molekuly vody, složené ze 6 atomů vodíku a 3 atomů kyslíku
HCl = Jedna molekula chorovodíku, složená z 1 atomu vodíku a 1 atomu chloru
CO2 = Jedna molekula oxidu uhličitého, složená z 1 atomu uhlíku a 2 atomů kyslíku
Molekula vody
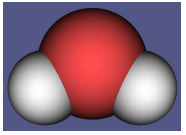
SLOUČENINA = látka vzniklá sloučením atomů dvou nebo více prvků.
Podle počtu prvků rozlišujeme sloučeniny na:
• Dvouprvkové – H2O, HCl, CO2
• Tříprvkové – H2SO4, NaOH, NaNO3
• Víceprvkové – CuSO4.5H2O, NH4NO3
CHEMICKÝ VZOREC = složení molekul vyjádřené značkami prvků a číslicemi
= sumární chemický vzorec udává tedy druh a počet atomů vázaných
v molekule sloučeniny
H2SO4 = Molekula kyseliny sírové složená ze 2 atomů vodíku, 1 atomu síry a 4 atomů kyslíku
NH3 = Molekula amoniaku složená z 1 atomu dusíku a 3 atomů vodíku



