Redoxní reakce
15. 7. 2021 2021-08-04 14:04Redoxní reakce
Redoxní reakce
REDOXNÍ REAKCE
Dnes je známo kolem 15 milionů chemických látek. Každá z nich může reagovat se stovkami
a tisíci jiných látek za vzniku nejrůznějších produktů.
Pro přehlednost je nutné chemické reakce třídit podle určitých znaků do skupin. Jednou
z nejvýznamnějších skupin reakcí jsou oxidačně redukční reakce.
Patří k nim například děje při:
• Hoření látek
• Dýchání organismů
• Výrobě kovů z rud
• Získávání elektrické energie z článků baterií a akumulátorů
• Korozi kovů
• Elektrolýze
• Vzniku fotografického obrazu černobílé fotografie
REDOXNÍ REAKCE jsou ty, při nichž dochází ke změnám oxidačních čísel atomů.
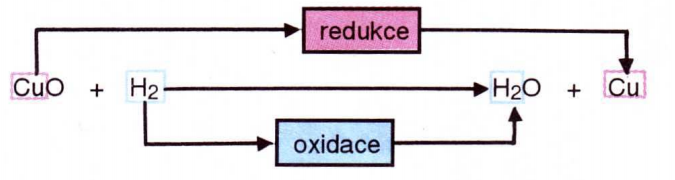
Každá redoxní reakce se skládá ze dvou dílčích reakcí – z oxidace a z redukce.
OXIDACE je děj, při kterém se oxidační číslo atomů prvku ZVĚTŠUJE.
REDUKCE je děj, při kterém se oxidační číslo atomů prvku ZMENŠUJE.
Redukce a oxidace probíhají vždy současně, proto se děje, při kterých probíhají, nazývají
redoxní reakce.
POZOR!!! Oxidační číslo nesloučených prvků je vždy 0!!!
Příklad:
Reakce vodíku s oxidem měďnatým:
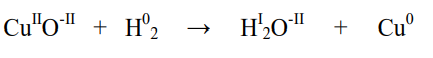
Ze zápisu je zřejmé, že oxidační číslo atomů:



Látka obsahující atomy, které se při reakci redukují, je OXIDAČNÍ ČINIDLO, protože jiné
látky oxiduje.
Látka obsahující atomy, které se při reakci oxidují, je REDUKČNÍ ČINIDLO, protože jiné
látky redukuje.
Ukázky redoxních reakcí:
• Hoření hořčíku ve vzduchu
• Reakce sodíku s chlorem
• Reakce síry s kyslíkem




