Významné halogenidy
14. 7. 2021 2021-08-04 14:00Významné halogenidy
Významné halogenidy
VÝZNAMNÉ HALOGENIDY
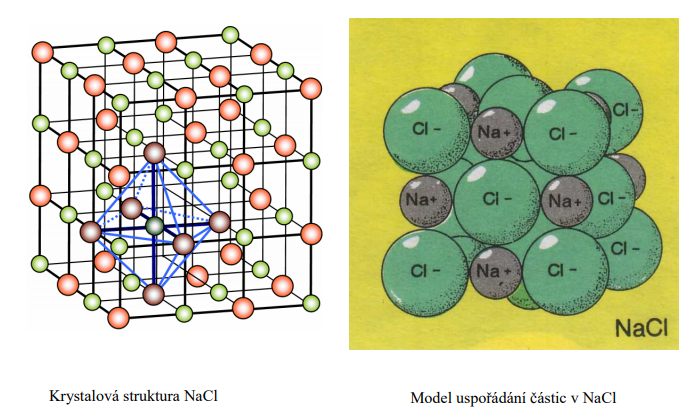
CHLORID SODNÝ NaCl
VÝSKYT:
• V přírodě se vyskytuje jako nerost sůl kamenná (halit)
• V běžném životě je znám jako kuchyňská sůl
• Získává se odpařováním mořské vody nebo těžbou z ložisek v zemi, které jsou
pozůstatkem pravěkých moří
VLASTNOSTI:
• Bílá krystalická látka
• Rozpustná ve vodě (slaná chuť)
• Jeho roztok i tavenina vede elektrický proud (v chloridu sodném se vyskytuje iontová
vazba Na+ , Cl- , každý ion Na+ je v krystalu obklopen 6 ionty Cl- a naopak)
• Při nahřátí plamenem se dá sůl roztavit a uvolňuje se přitom chlor
POUŽITÍ:
• Nezbytná složka potravy živočichů i člověka (jodizovaná sůl)
• Konzervace potravin – masa, ryb, zeleniny (bakterie způsobující hnilobu nemohou
žít v roztoku soli)
• Výroba chloru, chlorovodíku
• Výroba mýdla, zpracování kůží
• Odstraňování sněhu a námrazy na vozovkách a chodnících – toto uplatnění není
vhodné z hlediska ochrany životního prostředí!!

FLUORID VÁPENATÝ CaF2
• V přírodě se vyskytuje jako fialový nebo zelenomodrý nerost fluorit (kazivec)
• Bílá krystalická látka
• Nerozpustná iontová sloučenina C a F
• Základní zdroj výroby fluorovodíku HF

BROMID STŘÍBRNÝ AgBr
• Žlutá krystalická látka, prakticky nerozpustná ve vodě
• Na přímém slunečním světle se rozkládá, což se projevuje tmavnutím zpočátku
kanárkově žluté barvy na šedou (účinkem světla se rozkládá a černá)
• Díky své citlivosti na světlo se využívá při výrobě filmů pro černobílou fotografii,
rentgenové a radioaktivní snímkování
CHLORID KOBALTNATÝ CoCl2
• Je halogenid, který má různou barvu podle toho, s kolika molekulami se váže – pokud
se 2, je modrý, pokud se 6, je červený
• Používá se jako indikátor vlhkosti (přidává se k sušidlům)




