Významné nekovy – uhlík, síra, fosfor
13. 7. 2021 2021-08-04 13:58Významné nekovy – uhlík, síra, fosfor
Významné nekovy - uhlík, síra, fosfor
VÝZNAMNÉ NEKOVY
UHLÍK C
VÝSKYT A POUŽITÍ FOREM UHLÍKU:
A. V přírodě:
• DIAMANT, nejtvrdší nerost – šperky, broušení, vrtné soupravy
• GRAFIT (tuha), měkký nerost, vede el. proud – tužky, elektrody, mazadla ložisek
• UHLÍ, ROPA, ZEMNÍ PLYN – paliva
• SLOUČENINY jsou základem všech těl organismů na Zemi (biogenní prvek)
B. Uměle vyrobené formy:
• SAZE – výroba pryže na pneumatiky, výroba plastů
• KOKS – pevné palivo při výrobě surového železa
• AKTIVNÍ UHLÍ – má velký povrch a je schopno na něm zachycovat jedovaté plyny,
páry a barviva → tato schopnost se nazývá ADSORPCE, využívá se při výrobě filtrů
ochranných masek nebo jako lék při průjmových onemocněních Carbosorb.
VLASTNOSTI:
• Prvek IV A skupiny PSP, 4 valenční elektrony
• Nekov, biogenní prvek
• Po vodíku tvoří nejvíce sloučenin
• Stálý, málo reaktivní
SÍRA S
VÝSKYT:
• Volný prvek ( u sopek )
• Vázaná ve sloučeninách (sulfidy, sírany)
VLASTNOSTI:
• Prvek VI A skupiny PSP, 6 valenčních elektronů
• Nekov
• Pevná křehká látka, žlutá
• Nerozpustná ve vodě
• Tvoří několik forem, např. krystalická je z osmiatomových molekul S8
POUŽITÍ:
• Výroba kyseliny sírové H2SO4
• Výroba pryže z kaučuku
• Prostředky proti rostlinným škůdcům (pesticidy)
Hoření síry:

FOSFOR P (řec. phos = světlo a phero = nesu, světlonoš)
VÝSKYT A VLASTNOSTI:
• V A skupina PSP, 5 valenčních elektronů.
• Tvoří 3 různé modifikace
• V přírodě pouze vázaný ve sloučeninách (fosforečnany)
• V buňkách, kostech, zubech obratlovců
• Uměle připravené formy uhlíku:
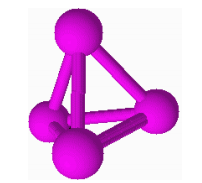
A. Bílý fosfor
• Pevná látka
• Tvoří čtyřatomové molekuly P4
• POZOR! Zvlášť nebezpečný jed
• Velmi reaktivní
• POZOR! Samozápalný, uchovává se pod vodou
• Ve tmě světélkuje (fosforescence)
• Použití – signalizační munice
– zápalné prostředky
– výroba kyseliny fosforečné

B. Červený fosfor
• Pevná látka
• Vzniká zahříváním bílého fosforu
• Není samozápalný ani jedovatý
• Méně reaktivní
• Molekuly mají podobu řetězců
• Použití – výroba zápalek (spolu se skelným prachem a oxidem manganičitým
je na škrtátku)

C. Černý fosfor
• Vzniká při dlouhodobém zahříváním bílého fosforu v inertní atmosféře
• Má vrstevnatou strukturu
• Krystalická látka, málo reaktivní
• Kovový lesk, tepelná a el. vodivost



